Die Fluorantimonsäure ist streng genommen keine definierte chemische Verbindung, sondern eine Mischung aus Fluorwasserstoff und Antimonpentafluorid, die verschiedene Kationen und Anionen enthält; die einfachsten sind das Fluoronium-Kation H2F+ (HF, protoniert) und das Hexafluoroantimonat-Anion SbF6-.
Die sehr gefährliche Chemikalie zählt zu den Supersäuren, also zu einer Gruppe chemischer Verbindungen, die eine höhere Acidität besitzen, als die der konzentrierten (100%igen) Schwefelsäure (H0 = - 11,9). Zudem ist die Fluorantimonsäure die - nach derzeitigem Kenntnisstand - stärkste bekannte Supersäure, basierend auf dem gemessenen Wert ihrer Hammett-Aciditätsfunktion (H0), der für verschiedene Mischungen von HF/SbF5 bestimmt wurde. Während der H0-Wert von reinem Fluorwasserstoff -15 beträgt, sinkt er durch Zugabe von nur 1 Mol-% SbF5 auf etwa -20. Die weitere Zugabe von Antimonpentafluorid führt jedoch zu schnell abnehmenden Werten, wobei die höchste Säurestärke und damit der kleinste H0-Wert von -21 bei 10 Mol-% SbF5 erreicht wird. Damit ist die Fluorantimonsäure etwa 2 × 1019 bzw. 20 Trillionen mal stärker als reine Schwefelsäure.
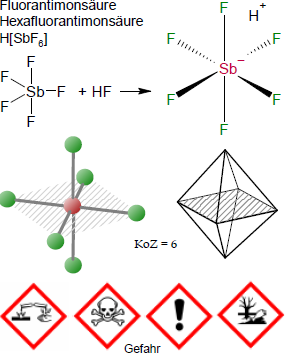
Bezeichnungen und Identifikatoren
Fluorantimonsäure
F6HSb
H[SbF6]
236,758 (g/mol)
16950-06-4
241-023-8
MBAKFIZHTUAVJN-UHFFFAOYSA-I
Weitere Bezeichnungen, Synonyme
Hexafluorantimonsäure
Englische Bezeichnung
Fluoroantimonic acid
Hydrogen stibanylidyne hexafluoride; Hexafluoroantimonic acid; Hexafluorostibonic acid
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Fluorantimonsäure:
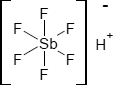
F6HSb oder H[SbF6]
Mr = 236,7584 g/mol
SMILES: [H+].F[Sb-](F)(F)(F)(F)F
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Fluorantimonsäure. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
Die Zusammensetzung der Fluorantimonsäure ist recht komplex und besteht im Grunde genommen aus einer Mischung von HF-solvatisierten Protonen wie [(HF)nH]+, H3F2+ etc. und SbF5-Addukten wie Sb4F21 usw. Somit sind die häufig dargestellten Formeln H[SbF6] und [H2F]+ SbF6- stark vereinfachte Annäherungen an die wahre Zusammensetzung. Außerdem handelt es sich bei der Säure um eine Mischung, die variabel gehalten werden kann. Genaue physikalische Daten lassen sich daher nicht darstellten.
Die Dichte der 1:1-Mischung wird in der Literatur allerdings mit 2,885 g cm-3 und der Dampfdruck mit 19 hPa bei 18 °C angegeben.
- Nicht unzersetzt löslich in herkömmlichen Lösungsmitteln, da sofort Zersetzung - teils mit heftigen Reaktionen - eintritt.
+ Löslich in Sulfurylchloridfluorid, Schwefeldioxid (jeweils flüssig) sowie einigen Fluorchlorkohlenwasserstoffen.
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Fluorantimonsäure - F6HSb - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Fluor
ΣAr = 113,990418978 u
19F: 18,9984 u [100 %]
19F: 48,1463 %
Wasserstoff
1H: 1,00783 u [99,99 %]
2H: 2,0141 u [0,01 %]
3H: 3,01605 u [<< 1 %]
1H: 0,42571 %
2H: 4,0E-5 %
3H: Spuren
Antimon
121Sb: 120,90381 u [57,21 %]
123Sb: 122,90421 u [42,79 %]
121Sb: 29,42193 %
123Sb: 22,00602 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 236,758418978 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 4,224 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,004 mol.
Monoisotopische Masse: 235,9020540102 Da - bezogen auf 19F61H121Sb.
Verwendung
Fluorantimonsäure wird in der Organische Synthese und in der Chemieindustrie vielfältig verwendet, um organische Verbindungen unabhängig von ihrem Lösungsmittel zu protonieren. Beispielsweise kann die Säure eingesetzt werden, um H2 aus Kohlenwasserstoffen wie Isobutan sowie Methan aus Neopentan - jeweils unter Bildung von Carbenium-Ionen - freizusetzen. Darüber hinaus dient sie als Katalysator für Alkylierungen und Acylierungen in der Petrochemie; und Supersäuren werden im Allgemeinen verwendet, um Carbokationen als reaktive Zwischenprodukte zu synthetisieren.
Schließlich dient die Fluorantimonsäure zur Synthese exotischer Substanzen wie etwa Tetraxenon-Goldverbindungen, die einen planaren Komplex der notorisch inerten Elemente Xenon und Gold enhalten.
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)




Signalwort: Gefahr
Gefahrenhinweise (H-Sätze):
- H300+H310+H330
Lebensgefahr bei Verschlucken, Hautkontakt oder Einatmen. - H314
Verursacht schwere Verätzungen der Haut und schwere Augenschäden. - H411
Giftig für Wasserorganismen, mit langfristiger Wirkung.
Zur Kennzeichnung in der EU siehe ECHA Substance Infocard 100.037.279 sowie Informationen zu REACh unter ECHA Chem 100.037.279.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Fluorantimonsäure als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[1] - Pierre M. Esteves, Alejandro Ramírez-Solís, Claudio J. A. Mota:
The Nature of Superacid Electrophilic Species in HF/SbF5: A Density Functional Theory Study.
In: Journal of the American Chemical Society, (2002), DOI 10.1021/ja011151k.
Letzte Änderung am 19.02.2024.
Permalink: https://www.internetchemie.info/substanz/Fluorantimonsäure.php
© 1996 - 2026 Internetchemie ChemLin