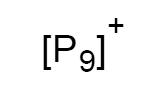Phosphor - chemisches Zeichen P, Ordnungszahl 15 - ist ein in drei allotropen Modifikationen sowie jeweils in unterschiedlichen Kristallstrukturen vorkommenendes chemisches Element der Stickstoffgruppe: weißer, roter und schwarzer Phosphor.
Übersicht: Allgemeine Daten zum Phosphor
Das Phosphor-Atom
Das P-Atom - und damit das chemische Element Phosphor - ist eindeutig durch die 15 positiv geladenen Protonen im Atomkern definiert. Für den elektrischen Ausgleich im ungeladenen P-Atom sorgt die gleiche Anzahl an Elektronen.
Für Unterschiede bei den Atomkernen sorgen die Kernbausteine der Neutronen. Diese Atomsorten werden unter dem Begriff Phosphor-Isotope zusammengefasst (Isotopen-Daten: siehe dort).
Die irdischen Phosphor-Vorkommen bestehen aus nur einem Isotop, so dass das Nichtmetall den monoisopischen Elementen zugeordnet wird. Die relative Atommasse des Phosphors wird mit 30,973761998(5) u angegeben.
Elektronenkonfiguration
| Symbol | OZ | Kurzform | 1s | 2s | 2p | 3s | 3p | 3d |
| P | 15 | [Ne] 3s2 3p3 | 2 | 2 | 6 | 2 | 3 |
Ionisierungsenergien
Die folgende Tabelle listet die Bindungsenergien bzw. die Ionisierungsenergien IE auf, also die erforderliche Energie in Elektronenvolt (eV), um ein bestimmtes Elektron von einem Phosphor-Atom vollständig zu trennen.
| 1. IE: | 10,48669 eV | 2. IE: | 19,7695 eV | 3. IE: | 30,20288 eV | 4. IE: | 51,4443 eV | 5. IE: | 65,02564 eV | 6. IE: | 220,423 eV |
| 7. IE: | 263,57 eV | 8. IE: | 309,60 eV | 9. IE: | 372,13 eV | 10. IE: | 424,43 eV | 11. IE: | 479,46 eV | 12. IE: | 560,8 eV |
| 13. IE: | 611,74 eV | 14. IE: | 2816,93 eV | 15. IE: | 3069,866 eV | 16. IE: | eV | 17. IE: | eV | 18. IE: | eV |
Elektronenbindungsenergie
Die nachfolgende Tabelle listet die Elektronenbindungsenergien der einzelnen Phosphor-Elektronen in den jeweiligen Orbitalen auf. Die Werte sind in Elektronenvolt (eV) angegeben.
| K | LI | LII | LIII |
| 1s | 2s | 2p1/2 | 2p3/2 |
| 2145,5 | 189 | 136 | 135 |
Weitere Daten
100 pm (empirisch, nach Slater)
111 pm (in Einfach-Bindungen, nach Pyykkö et al.)
102 pm (in Zweifach-Bindungen, nach Pyykkö et al.)
94 pm (in Dreifach-Bindungen, nach Pyykkö et al.)
Spektrallinien des Phosphors
Die nachfolgende Abbildung zeigt ein Emissionsspektrum des Phosphors mit den charakteristischen Spektrallinien im sichtbaren Wellenlängenbereich zwischen 400 und 700 nm:

Chemische Daten
2,06 nach Allred-Rochow
2,253 nach Allen
2,3 nach Mulliken
2,16 nach Sanderson
6,3405 eV nach Gosh-Gupta
5,62 eV nach Pearson
Standardpotentiale
Normalpotential des Phosphors:
| E0 (V) | Nox | Name Ox. | Ox. | e- | ⇔ | Red. | Name Red. | Nox |
| -0,499 | + III | Phosphonsäure | H3PO3 (aq) + 2 H+ | + 2 e- | ⇔ | H3PO2 + H2O | Phosphinsäure | + I |
| -0,276 | + V | Phosphorsäure | H3PO4 (aq) + 2 H+ | + 2 e- | ⇔ | H3PO3 (aq) + H2O | Phosphonsäure | + III |
| -0,111 | 0 | Phosphor, rot | P + 3 H+ | + 3 e- | ⇔ | PH3 (g) | Monophosphan | - III |
| -0,063 | 0 | Phosphor, weiß | P + 3 H+ | + 3 e- | ⇔ | PH3 (g) | Monophosphan | - III |
Material- und physikalische Eigenschaften des Phosphors
Die nachfolgende Übersicht führt einige physikalische Daten sowie Materialeigenschaften des reinen Phosphors auf.
597,2 °C (rot)
431 °C (rot, Sublimation)
620 °C (violett, Sublimation)
weißer P, gasförmig: 20,8 J mol-1 K-1 (molar)
weißer P, Feststoff: 23,8 J mol-1 K-1 (molar)
roter P: 0,684 J g-1 K-1 (spezifisch)
schwarzer P: 12,1 W m-1 K-1
1,823 g cm-3 (weiß)
2,36 g cm-3 (violett)
2,69 g cm-3 (schwarz)
jeweils bei Raumtemperatur.
Externe Informationsangebote
Informationen, Daten zum Element
Das Element Phosphor
Lebensnotwendig, hochgiftig, vielseitig
Phosphor bleibt spannend
Vortragsskript: Anorganisches Kolloquium. Universität Regensburg - Format: PDF
Weißer Phosphor
Strukturtypen-Datenbank. Universität Freiburg
Gruppenelemente - Informationen
Elemente der V. Hauptgruppe (Pnicogene, Pentele)
Vorlesungsskript: Anorganische Strukturchemie. Universität Freiburg
Pentele: Gruppe 15
Vorlesungsunterlagen: Chemie der Elemente. Universität Marburg - Format: PDF
Stickstoffgruppe (Pentele)
Daten, Eigenschaften im Überblick. Rutherford - Lexikon der Elemente
Verbindungsklassen
Wasserfreie Phosphate der Übergangsmetalle
Neue Untersuchungen an wasserfreien Phosphaten der Übergangsmetalle. Dissertation, 1999 - Format: PDF
Einzelne Verbindungen
Phosphor und Phosphorverbindungen
Chemikalien-Datenbank: physikalische und chemische Eigenschaften, Sicherheitsdatenblätter, kommerziell verfügbaren Stoffen und Verbindungen; verschiedene Suchkriterien einschließlich Struktursuche
Geochemie und Biogeochemie
Phosphorhaltige Minerale
Informationen zum Phosphor und den Phosphormineralien. Mineralien Atlas
Phosphorkreislauf
Übersichtsfolie
Sicherheitsinformationen
Phosphor-32
Sicherheitsinformationen P-32. BG Chemie - Format: PDF
Toxikologie, Medizin, Physiologie
Phosphor
Klinische Toxikologie des roten und des violetten Phosphors - Format: PDF
Newsarchiv
Ein reines Phosphorkation:
Freiburger Wissenschaftler haben entscheidenden Zugang zur Synthese gefunden.
Effizient und umweltfreundlich: Wiedergewinnung von reinem Phosphat aus Abwasser; Zum Patent angemeldete Erfindung löst Problem der Rohstoffverknappung.
Dem verschwenderischen Umgang mit 'Lebensquell Phosphor' deutlich Riegel vorschieben: DBU und Land Rheinland-Pfalz fördern wegweisendes Projekt der Chemischen Fabrik Budenheim zum Phosphorrecycling aus Klärschlamm.
Kategorie: Chemische Elemente
Aktualisiert am 10.03.2020.
Permalink: https://www.internetchemie.info/chemische-elemente/phosphor.php
© 1996 - 2026 Internetchemie ChemLin