
Scandium - Symbol Sc, Ordnungszahl 21 - ist ein silberweißes Leichtmetall der 3. Gruppe im Periodensystem und kommt in der Natur nur in Form des Isotops 45Sc vor.
Übersicht: Allgemeine Daten zum Scandium
Das Scandium-Atom
Das Sc-Atom - und damit das chemische Element Scandium - ist eindeutig durch die 21 positiv geladenen Protonen im Atomkern definiert. Für den elektrischen Ausgleich im ungeladenen Scandium-Atom sorgt die gleiche Anzahl an Elektronen.
Für Unterschiede bei den Atomkernen sorgen die Kernbausteine der Neutronen. Diese Atomsorten werden unter dem Begriff Scandium-Isotope zusammengefasst (Isotopen-Daten: siehe dort).
Die irdischen Scandium-Vorkommen bestehen aus nur einem Scandium-Nuklid; es besitzt die Massenzahl 45. Die relative Atommasse des Scandiums wird mit 44,955908(5) u angegeben.
Elektronenkonfiguration
| Symbol | OZ | Kurzform | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f |
| Sc | 21 | [Ar] 3d1 4s2 | 2 | 2 | 6 | 2 | 6 | 1 | 2 |
Ionisierungsenergien
Die folgende Tabelle listet die Bindungsenergien bzw. die Ionisierungsenergien IE auf, also die erforderliche Energie in Elektronenvolt (eV), um ein bestimmtes Elektron von einem Scandium-Atom zu trennen.
| 1. IE: | 6,56149 eV | 2. IE: | 12,79977 eV | 3. IE: | 24,75685 eV | 4. IE: | 73,4900 eV | 5. IE: | 91,65 eV | 6. IE: | 110,68 eV |
| 7. IE: | 138,0 eV | 8. IE: | 158,1 eV | 9. IE: | 180,03 eV | 10. IE: | 225,18 eV | 11. IE: | 249,800 eV | 12. IE: | 687,36 eV |
| 13. IE: | 756,7 eV | 14. IE: | 830,8 eV | 15. IE: | 927,5 eV | 16. IE: | 1009 eV | 17. IE: | 1094 eV | 18. IE: | 1213 eV |
| 19. IE: | 1287,98 eV | 20. IE: | 5674,8 eV | 21. IE: | 6033,758 eV | 22. IE: | eV | 23. IE: | eV | 24. IE: | eV |
Elektronenbindungsenergie
Die nachfolgende Tabelle listet die Elektronenbindungsenergien der einzelnen Scandium-Elektronen in den jeweiligen Orbitalen auf. Die Werte sind in Elektronenvolt (eV) angegeben.
| K | LI | LII | LIII |
| 1s | 2s | 2p1/2 | 2p3/2 |
| 4492 | 498,0 | 403,6 | 398,7 |
| MI | MII | MIII | MIV | MV |
| 3s | 3p1/2 | 3p3/2 | 3d3/2 | 3d5/2 |
| 51,1 | 28,3 | 28,3 |
Weitere Daten
160 pm (empirisch, nach Slater)
148 pm (in Einfach-Bindungen, nach Pyykkö et al.)
116 pm (in Zweifach-Bindungen, nach Pyykkö et al.)
114 pm (in Dreifach-Bindungen, nach Pyykkö et al.)
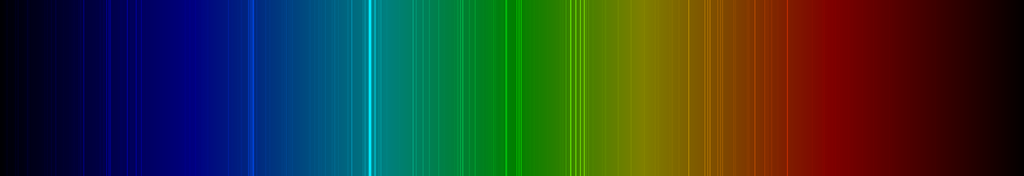
Spektrallinien des Scandiums
Die nachfolgende Abbildung zeigt ein Emissionsspektrum des Scandiums mit den charakteristischen Spektrallinien im sichtbaren Wellenlängenbereich zwischen 400 und 700 nm:
Chemie des Scandiums
In den Scandium-Verbindungen tritt das Metall - bis auf einige wenige, aber dennoch gut charakterisierte Ausnahmen - in der Oxidationsstufe +III auf.
In reinem Zustand ist Scandium ein weiches Metall mit einem silbrigen Aussehen. Es entwickelt einen leicht gelblichen oder rosafarbenen Schimmer, wenn es durch den Luftsauerstoff oxidiert wird. Es ist witterungsempfindlich und löst sich in den meisten verdünnten Säuren langsam auf. Scandium-Späne entzünden sich spontan an der Luft mit einer leuchtend gelben Flamme unter Bildung von Scandiumoxid.
Chemische Daten
1,20 nach Allred-Rochow
1,19 nach Allen
1,09 nach Sanderson
2,8571 eV nach Gosh-Gupta
3,34 eV nach Pearson
Standardpotentiale
Normalpotential des Scandiums:
| E0 (V) | Nox | Name Ox. | Ox. | e- | ⇔ | Red. | Name Red. | Nox |
| -2,077 | + III | Scandium(III)-Kation | Sc3+ | + 3 e- | ⇔ | Sc (s) | Scandium | 0 |
Material- und physikalische Eigenschaften des Scandiums
Die nachfolgende Übersicht führt einige physikalische Daten sowie Materialeigenschaften des reinen Scandium-Metalls auf.
0,568 J g-1 K-1 (spezifisch)
2,80 g cm-3 (flüssig, am Schmelzpunkt)
377,8 kJ mol-1 (gasförmig)
174,8 J mol-1 K-1 (gasförmig)
Geochemie, Vorkommen, Verteilung
In der Erdkruste steht das Scandium an 35. Stelle der Häufigkeiten der Elemente; die Schätzungen variieren zwischen 18 und 25 ppm, was in etwa mit dem Vorkommen des Cobalts vergleichbar ist. Bezogen auf die gesamte Erde rückt das Seltenerdmetall an die 50. Stelle und bezogen auf die Sonne an 23. Stelle. Das stabile Scandium-Isotop wird in Supernovas durch den r-Prozess erzeugt.
ist Scandium ist in der Erdkruste jedoch stark verteilt und kommt in vielen Mineralien nur in Spuren vor. Seltene Mineralien aus Skandinavien und Madagaskar wie Thortveitit, Euxenit und Gadolinitsind die einzigen bekannten konzentrierten Quellen des Elements. Thortveitit kann bis zu 45% Scandium in Form von Scandiumoxid enthalten.
Auf Grund der geringen Verfügbarkeit und der hohen Nachfrage ist das Scandium eines der teuersten Elemente. Der Preis schwankt sehr stark und liegt pro Kilogramm in der Größenordnung von 5000 bis 15000 Euro. Die weltweite Produktion liegt bei etwa 15 bis 20 Tonnen pro Jahr in Form von Scandiumoxid, das in Scandiumfluorid umgewandelt und dann mit metallischem Calcium reduziert wird.
Gefahren und Sicherheit
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit)

Gefahr
H228 - Entzündbarer Feststoff.
P210 - Von Hitze, heißen Oberflächen, Funken, offenen Flammen sowie anderen Zündquellenarten fernhalten. Nicht rauchen.
Quelle: Echa Substanz-Info 100.028.299.
Externe Informationsangebote
Gruppenelemente - Informationen
Koordinationschemie
Einführung in die Koordinationschemie der Übergangsmetalle / Inneren Übergangsmetalle. Universität Marburg - Format: PDF
Scandium-Gruppe
Vorlesungsskript: Chemie der Metalle. Universität Freiburg
Einzelne Verbindungen
Scandium und Scandiumverbindungen
Chemikalien-Datenbank: physikalische und chemische Eigenschaften, Sicherheitsdatenblätter, kommerziell verfügbare Stoffen und Verbindungen; verschiedene Suchkriterien einschließlich Struktursuche
Scandiumboride
Synthese, Struktur- und Eigenschaftsuntersuchungen borreicher Boride des Magnesiums, Scandiums, Yttriums und der Lanthanoide. Dissertation, 2009. Universität Freiburg
Mineralogie
Geochemie der Seltenen Erden
Umfassendes Vorlesungsskript - Format: PDF
Scandiumhaltige Minerale
Informationen zum Scandium und den Scandiummineralien. Mineralien Atlas
Dissertationen
Eisen-Scandium-Legierungen
Magnetische und strukturelle Charakterisierung von amorphen Eisen-Scandium-Legierungen. Dissertation, 2004. TU Darmstadt
Scandiumhaltige AlZnMgCu-Legierungen
Korrosionsuntersuchungen an scandiumhaltigen AlZnMgCu-Legierungen unter besonderer Berücksichtigung des Einflusses intermetallischer Phasen. Dissertation, 2007. Universität Erlangen
Kategorie: Chemische Elemente
Aktualisiert am 17.04.2020.
Permalink: https://www.internetchemie.info/chemische-elemente/scandium.php
© 1996 - 2026 Internetchemie ChemLin