
Silber ist ein chemisches Element aus der Gruppe der Übergangsmetalle mit dem von der lateinischen Bezeichnung abgeleiteten Elementsymbol Ag und der Ordnungszahl 47. Das Edelmetall ist in reinem Zustand weich, weiß, polierbar sowie charakterisitsch weiß-glänzend und weist die höchste elektrische Leitfähigkeit, beste Wärmeleitfähigkeit und das stärkste Licht-Reflektionsvermögen aller Metalle auf, begründet in dem Vorhandensein eines einzelnen Elektrons in der äußersten Schale, das frei beweglich ist und nicht mit der gefüllten d-Unterschale wechselwirkt.
Übersicht: Allgemeine Daten zum Silber
Das Silber-Atom
Identifikations-Merkmal für das Ag-Atom - und somit für das Element Silber - ist das Vorhandensein von 47 Protonen im Atomkern; man nennt diese Zahl Kernladungszahl oder Protonenzahl und sie entspricht der Ordnungszahl, die wiederum die Stellung des Silbers im Atomkern bestimmt. Im ungeladenen und damit elektrisch neutralen Ag-Atom befinden sich zudem 47 Elektronen in der Elektronhülle.
Für Unterschiede bei den Silber-Atomkernen bei gleichbleibender Kernladungszahl sorgen die Kernbausteine der Neutronen. Diese Atomsorten werden unter dem Begriff Silber-Isotope bzw. Silber-Nuklide zusammengefasst (Isotopen-Daten: siehe dort).
Die irdischen SIlber-Vorkommen bestehen aus einem Gemisch zweier Nuklide unterschiedlicher Masse; die relative Atommasse wird daher mit 107,8682(2) u angegeben.
Elektronenkonfiguration
| Symbol | OZ | Kurzform | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f |
| Ag | 47 | [Kr] 4d10 5s1 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 1 |
Ionisierungsenergien
Die folgende Tabelle listet die Bindungsenergien bzw. die Ionisierungsenergien IE des Silbers auf, also die erforderliche Energie in Elektronenvolt (eV), um ein bestimmtes Elektron von einem Ag-Atom zu trennen.
| 1. IE: | 7,57623 eV | 2. IE: | 21,47746 eV | 3. IE: | 34,83 eV | 4. IE: | eV | 5. IE: | eV | 6. IE: | eV |
Elektronenbindungsenergie
Die nachfolgende Tabelle listet die Elektronenbindungsenergien der einzelnen Silber-Elektronen in den jeweiligen Orbitalen auf. Die Werte sind in Elektronenvolt (eV) angegeben.
| K | LI | LII | LIII |
| 1s | 2s | 2p1/2 | 2p3/2 |
| 25514 | 3806 | 3524 | 3351 |
| MI | MII | MIII | MIV | MV |
| 3s | 3p1/2 | 3p3/2 | 3d3/2 | 3d5/2 |
| 719 | 603,8 | 573 | 374 | 368,3 |
| NI | NII | NIII | NIV | NV | NVI | NVII |
| 4s | 4p1/2 | 4p3/2 | 4d3/2 | 4d5/2 | 4f5/2 | 4f7/2 |
| 97 | 63,7 | 58,3 |
Weitere Daten
160 pm (empirisch, nach Slater)
128 pm (in Einfach-Bindungen, nach Pyykkö et al.)
139 pm (in Zweifach-Bindungen, nach Pyykkö et al.)
137 pm (in Dreifach-Bindungen, nach Pyykkö et al.)
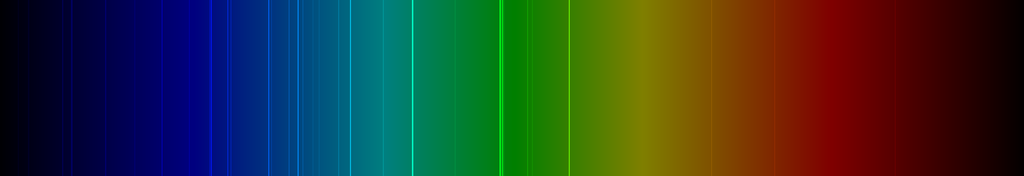
Spektrallinien des Silbers
Die nachfolgende Abbildung zeigt ein Emissionsspektrum des Silbers mit den charakteristischen Spektrallinien im sichtbaren Wellenlängenbereich zwischen 400 und 700 nm:
Chemie des Silbers
Als Edelmetall ist Silber chemisch recht unreaktiv. Die vorherrschende Oxidationsstufe ist +I.
Chemische Daten
1,87 nach Allen
3,6842 eV nach Gosh-Gupta
4,44 eV nach Pearson
Standardpotentiale
Normalpotential des Silbers:
| E0 (V) | Nox | Name Ox. | Ox. | e- | ⇔ | Red. | Name Red. | Nox |
| -0,15224 | + I | Silberiodid | AgI (s) | + e- | ⇔ | Ag (s) + I- | Silber | 0 |
| 0,07133 | + I | Silberbromid | AgBr (s) | + e- | ⇔ | Ag (s) + Br- | Silber | 0 |
| 0,22233 | + I | Silberchlorid | AgCl (s) | + e- | ⇔ | Ag (s) + Cl- | Silber | 0 |
| 0,7996 | + I | Silber-Kation | Ag+ | + e- | ⇔ | Ag (s) | Silber | 0 |
| 1,17 | + I | Silber(I)-oxid | Ag2O (s) + 2 H+ | + 2 e- | ⇔ | 2 Ag (s) + H2O | Silber | 0 |
| 1,67 | + III | Silber(III)-oxid | Ag2O3 (s) + 6 H+ | + 4 e- | ⇔ | 2 Ag+ + 3 H2O | Silber-Kation | + I |
| 1,772 | + II | Silberoxid | AgO (s) + 2 H+ | + e e- | ⇔ | Ag+ + H2O | Silber-Kation | + I |
| 1,98 | + II | Silber(II)-Kation | Ag2+ | + e- | ⇔ | Ag+ | Silber-Kation | + I |
Material- und physikalische Eigenschaften des Silbers
Die nachfolgende Tabelle führt einige physikalische Daten sowie Materialeigenschaften des reinen Silber-Metalls auf.
0,235 J g-1 K-1 (spezifisch)
9,320 g cm-3 (flüssig, am Schmelzpunkt)
nach Vickers: 0,251 GPa
nach Brinell: 0,0245 GPa
nach Brinell (neu): 0,206 GPa (geglüht)
284,9 kJ mol-1 (gasförmig)
173,0 J mol-1 K-1 (gasförmig)
Gefahren und Sicherheit
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit)

Achtung
H400 - Sehr giftig für Wasserorganismen.
H410 - Sehr giftig für Wasserorganismen mit langfristiger Wirkung.
Quelle: Echa Substanz-Info 100.028.301.
Externe Informationsangebote
Spezielle Teilinformationen
Angelaufenes Silber
Wie funktioniert das Reinigen von angelaufenem Silber?
Nanosilber - Altbewährtes mit neuem Etikett
Nanosilber ist keine neue Erfindung der Nanotechnologien, sondern bereits seit mehr als 100 Jahren in verschiedenen Produkten im Einsatz
Silber- und Kupfer-Sinterkörper
Artikel: Katalytisch aktive Materialien. TU Darmstadt - Format: PDF
Silberpartikelfolie als Bakterienkiller
Forschende der ETH Zürich haben eine neuartige Kunststofffolie entwickelt, die mit Nanopartikeln aus Silber und Calciumphosphat beschichtet ist. Da sie für Bakterien tödlich ist, kann sie in Spitälern und in der Lebensmittelindustrie zur Eliminierung von Keimen genutzt werden. Artikel, Juli 2008
Geschichtliches zum Thema / historische Dokumente
Das Probieren der Münzmetalle
Historischer Text. TU Chemnitz - Format: PDF
Experimente, Versuchsanleitungen
Silberbäumchen
Anleitung eines so genannten Petrischalenversuchs. Universität Bayreuth
Gruppenelemente - Informationen
Münzmetalle - Komplexchemie
Komplexchemie der Münzmetalle Kupfer, Silber und Gold
Übergangsmetalle
Vorlesungsskript. Universität Rostock - Format: PDF
Übergangsmetalle
Vorlesungsskript: Chemie der Übergangselemente, Koordinationschemie, Stoffchemie - Format: PDF
Übergangsmetalle
Übergangsmetalle Gruppen 3-12; Innere Übergangsmetalle. Universität Marburg - Format: PDF
Verbindungsklassen
Silber-Chemikalien
Chemikalien-Datenbank: physikalische und chemische Eigenschaften, Sicherheitsdatenblätter, kommerziell verfügbaren Stoffen und Verbindungen; verschiedene Suchkriterien einschließlich Struktursuche
Silbereiweiß
Informationsseite zum Silberproteinat = Silbereiweiß
Silberhalogenide
Schwerlösliches wird durch Komplexbildung löslich. Universität Bielefeld
Silber-Nanopartikel
Synthese, Löslichkeit und biologische Aktivität von Silber-Nanopartikeln. Dissertation, 2009. Universität Duisburg-Essen
Synthese, Herstellung, Produktion
Übergangsmetalle
Gewinnung und Reinigung. FH Münster - Format: PDF
Analyse und Bestimmung
HCl-Gruppe
Silber, Blei, Quecksilber. FH Münster - Format: PDF
HCl-Gruppe
Der virtuelle Trennungsgang: Abtrennung von Pb, Hg und Ag. Universität Freiburg
Kupfergruppe
Trennungsgang. Universität Graz, Österreich - Format: PDF
Silber Nachweis
Demonstrationsversuch. Universität Regensburg - Format: PDF
Mineralogie
Silber Lagerstätten
Auflistung von Silbervorkommen: Mineralienatlas
Silberhaltige Minerale
Informationen zum Silber und den Silbermineralien. Mineralien Atlas
Kategorie: Chemische Elemente
Aktualisiert am 24.04.2020.
Permalink: https://www.internetchemie.info/chemische-elemente/silber.php
© 1996 - 2026 Internetchemie ChemLin