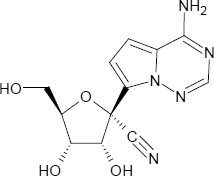
Remdesivir ist eine organisch-chemische Verbindung, die als pharmazeutischer Wirkstoff aus der Gruppe der Nukleosid-Analoga als Virustatikum gegen verschiedene eingesetzt wird (Entwicklungscode GS-5734).
Bezeichnungen und Identifikatoren
Remdesivir
C27H35N6O8P
602,585 (g/mol)
1809249-37-3
852-825-8
RWWYLEGWBNMMLJ-YSOARWBDSA-N
Systematischer Name
2-Ethylbutyl-(2S)-2-{[(S)-{[(2R,3S,4R,5R)-5-(4-aminopyrrolo[2,1-f][1,2,4]triazin-7-yl)-5-cyan-3,4-dihydroxytetrahydro-2-furanyl]methoxy}(phenoxy)phosphoryl]amino}propanoat
Englische Bezeichnung
Remdesivir
GS-5734
Chemische Formeln
Brutto- bzw. Summenformel und Strukturformel der chemischen Verbindung Remdesivir:
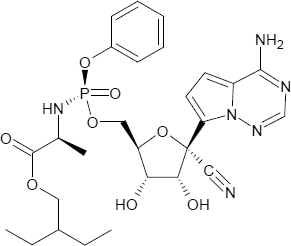
C27H35N6O8P
Mr = 602,5848 g/mol
2-Ethylbutyl-(2S)-2-{[(S)-{[(2R,3S,4R,5R)-5-(4-aminopyrrolo[2,1-f][1,2,4]triazin-7-yl)-5-cyan-3,4-dihydroxytetrahydro-2-furanyl]methoxy}(phenoxy)phosphoryl]amino}propanoat
SMILES: CCC(CC)COC(=O)[C@H](C)N[P@](=O)(OC[C@@H]1[C@H]([C@H]([C@](O1)(C#N)c2ccc3n2ncnc3N)O)O)Oc4ccccc4
Daten und Eigenschaften
Übersicht über die (bekannten) chemischen und physikalischen Eigenschaften: Remdesivir. Es gelten - soweit nicht anders angegeben - Raumumgebungsbedingungen (Normaldruck, 0 % Luftfeuchtigkeit, 20 °C).
Spektroskopische Daten:
Berechnetes NMR-Spektrum (Predict Spectra via NMRDB)
1H NMR Spektrum, 13C NMR Spektrum.
Prozentuale und isotopische Zusammensetzung:
Massenbezogene elementare Zusammensetzung und Isotopen-Anteile der Verbindung Remdesivir - C27H35N6O8P - berechnet auf Grundlage der Molekülmasse.
.Element E
der Atome Ex
und der Isotope *
der Isotope
Ex an Formelmasse
Kohlenstoff
ΣAr = 324,297 u
12C: 12 u [98,94 %]
13C: 13,00335 u [1,06 %]
14C: 14,00324 u [<< 1 %]
12C: 53,24719 %
13C: 0,57047 %
14C: Spuren
Wasserstoff
ΣAr = 35,28 u
2H: 2,0141 u [0,01 %]
3H: 3,01605 u [<< 1 %]
1H: 1,00783 u [99,99 %]
2H: 0,00059 %
3H: Spuren
1H: 5,85419 %
Stickstoff
ΣAr = 84,042 u
14N: 14,00307 u [99,6205 %]
15N: 15,00011 u [0,3795 %]
14N: 13,89399 %
15N: 0,05293 %
Sauerstoff
ΣAr = 127,992 u
17O: 16,99913 u [0,03835 %]
18O: 17,99916 u [0,205 %]
16O: 15,99491 u [99,757 %]
17O: 0,00815 %
18O: 0,04354 %
16O: 21,18888 %
Phosphor
31P: 30,97376 u [100 %]
31P: 5,14015 %
*) Die dritte Spalte führt die Atommassen bzw. Isotopenmassen der beteligten Elemente sowie - in eckigen Klammern - die natürliche Isotopenzusammensetzung auf.
Weitere berechnete Daten
Die molare Masse ist M = 602,584761998 Gramm pro Mol.
Die Stoffmenge von einem Kilogramm der Substanz ist n = 1,66 mol.
Die Stoffmenge von einem Gramm der Substanz ist n = 0,002 mol.
Monoisotopische Masse: 602,22539910251 Da - bezogen auf 12C271H3514N616O831P.
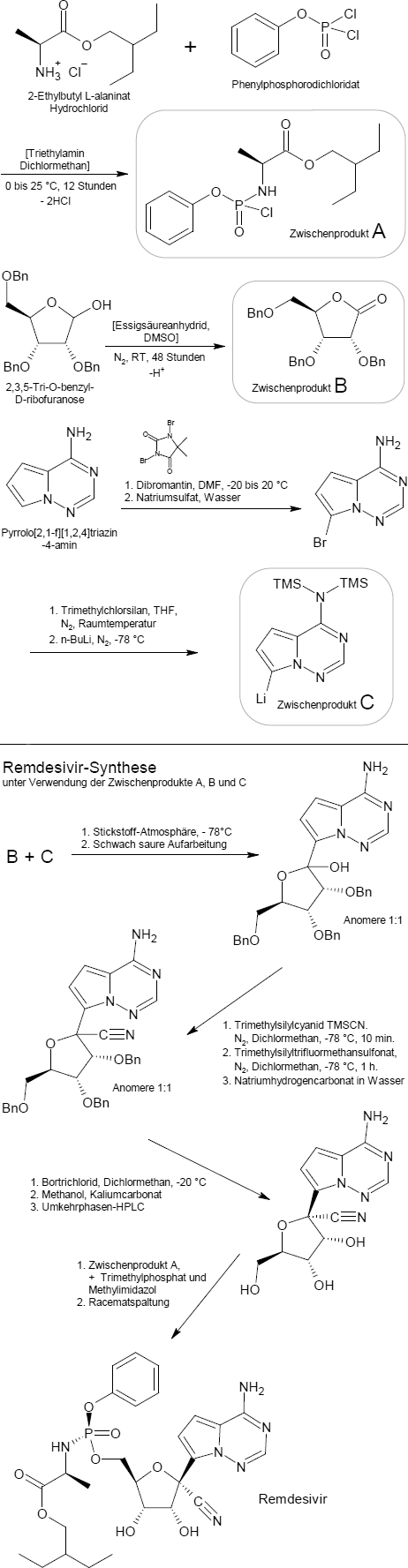
Synthese, Gewinnung
Das nachfolgende Schema zeigt die ursprüngliche Synthese des Remdesivirs, die in mehreren Stufen erfolgt. Zentrales Molekül ist hierbei die Ribose, die mit drei Benzyl-Gruppen als Schutzgruppen in Form der 2,3,5-Tri-O-benzyl-D-ribofuranose eingesetzt wird. Im Vorfeld der eigentlichen Synthese wurden die drei Zwischenprodukte A, B und C hergestellt:
Das Zwischenprodukt A ist aus L-Alanin und Phenylphosphorodichloridat in Gegenwart von Triethylamin und Dichlormethan zugänglich. Die Benzyl-geschützte Ribose wird in einem zweiten Schritt in Dimethylsulfoxid (DMSO) mit Acetanhydrid oxidiert uns so zum Zwischenprodukt B - einem Lacton - umgesetzt. Das Zwischenprodukt C schließlich entsteht durch Bromierung von Pyrrolo[2,1-f][1,2,4]triazin-4-amin mit Dibromantin, durch Einführung von Trimethylsilyl-Schutzgruppen (TMS) für die Amin-Gruppe und der Brom-Lithium-Austauschreaktion mit n-Butyllithium.
Die eigentliche Remdesivir-Synthese beginnt mit der tropfenweisen Zugabe des Zwischenprodukts B zu C in einer Stickstoffatmosphäre bei -78 ° C und anschließendem Reaktionsabbruch durch Zugabe einer schwach sauren Lösung. Das Reaktionsgemisch aus den Anomeren wird dann mit einem Überschuss an Trimethylsilylcyanid in Dichlormethan bei -78 °C 10 Minuten lang umgesetzt und dann Trimethylsilyltriflat (Trimethylsilyltrifluormethansulfonat) zugegeben. Nach einer Stunde wird die Mischung mit einer wässrigen Natriumhydrogencarbonat-Lösung (Natron) gequencht. Das Resultat ist ein Zwischenprodukt mit der gewünschten Nitril-Funktion.
Die Schutzgruppe Benzyl wird nun mit Bortrichlorid in Dichlormethan bei -20 °C entfernt. Der Überschuss an Bortrichlorid wird in einer Mischung aus Kaliumcarbonat und Methanol gequencht. Man erhält ein benzylfreies Zwischenprodukt.
Die Isomere werden dann mittels Umkehrphasen- HPLC getrennt. Die optisch reine Substanz und sowie das Zwischenprodukt A werden nun mit Trimethylphosphat und Methylimidazol umgesetzt, um ein Diastereomerengemisch von Remdesivir zu erhalten. Am Ende kann optisch reines Remdesivir durch chirale Auflösungsverfahren erhalten werden.
Wirkstoff Remdesivir
Lateinische Bezeichnung: Remdesivirum.
ATC-Code:J05AB16
Remdesivir wurde von dem US-amerikanischen Pharmazie- und Biotechnologieunternehmen Gilead Sciences zunächst zur Behandlung von Ebola-Virus-Erkrankungen und Marburg-Virus-Infektionen entwickelt. Später wurde festgestellt, dass der Wirkstoff eine antivirale Aktivität gegen andere einzelsträngige RNA-Viren wie das respiratorische Syncytial-Virus, das Junin-Virus und das Lassa-Fieber-Virus aufweist. Neuerdings wird auch die Wirksamkeit des Remdesivirs gegen das Nipah-Virus, das Hendra-Virus und die Coronaviren (einschließlich MERS-, SARS- und SARS-CoV-2-Viren) erforscht.
Remdesivir ist ein sog. Prodrug, das erst im Organismus in seine aktive Form GS-441524 umgewandelt wird. Als Adenosin-Nucleotid-Analogon wirkt die Substanz auf die virale RNA-Polymerase und stört das Korrekturlesen durch die virale Exoribonuklease (ExoN), was zu einer Verringerung der viralen RNA-Produktion führt. Zunächst war nicht bekannt, ob der Wirkstoff RNA-Ketten terminiert oder Mutationen in ihnen verursachE. Es wurde jedoch festgestellt, dass die RNA-abhängige RNA-Polymerase des Ebolavirus größtenteils durch verzögerten Kettenabbruch gehemmt wird.
In der Tiermedizin zeigte sich Remdesivir - ebenfalls als Vorstufe der Wirkstoffs GS-441524 - als Therapeutikum bei der sonst nicht behandelbaren Infektionskrankheit Feline Infektiöse Peritonitis (FIP), die durch das Feline Coronavirus (FCoV, Spezies Alphacoronavirus 1) verursacht wird, wirksam [vgl. Niels C. Pedersen et al., 2019]. Eine Zulassung gibt es zur Zeit nicht.
Struktur und Wirkung
Warum und wie Remdesivir auf Viren wirkt lässt sich zum Teil an Hand der molekularen Struktur und dem Einfluss einzelner Strukturelemente zeigen.
Die Substanz ist ein Nukleosid-Analogon in dem Sinne, dass es ähnlich aufgebaut ist, wie das Nucleosid Adenosin [siehe jeweils Formelbilder], einem Molekül aus dem Zucker Ribose (blau im Formelbild), die über eine N-glykosidische Bindung mit der stickstoffhaltigen Base Adenin verbunden ist. Das Adenosin ist nun ein wichtiger biochemischer Grundstoff, der Bestandteil von Biomolekülen wie den Adenosinphosphaten (ATP, ADP, AMP), der Ribonukleinsäure (RNA) sowie verschiedenen Cofaktoren ist. Die Viren benötigen Adenosin, um ihre Genome zu replizieren und sich im Wirtskörper zu vermehren.
Ein Vergleich beider Substanzen lässt folgende Unterschiede [gelbe Markierungen] in Struktur und Funktion erkennen:
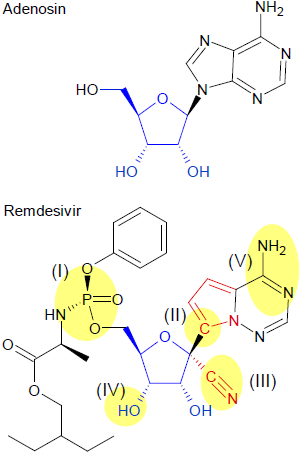
(I)
Die Phosphat-Gruppe mit ihren Substituenten ist Ergebnis einer neueren Methode der Wirkstoffforschung, die auch als ProTide-Technologie - ein Kunstwort aus PROdrug + NucleoTIDE - bezeichnet wird. Diese auch als Schutzgruppe anzusehende Molekülstruktur erfüllt zwei Funktionen: Sie verringert die Polarität des Remdesivirs und lässt das Molekül durch die Plasmamembran hindurch in die Zellen gelangen. Remdesivir ist demnach also eine Vorstufe (Prodrug) des eigentlichen Wirkstoffs, der durch diese Schutzfunktion unverändert an den Zielort gelangen kann.
Innerhalb der Zelle wird diese Atomgruppierung durch die biochemischen Prozesse vom Molekül abgespalten; sie ist für den weiteren Verlauf ohne Bedeutung. Freigesetzt wird dabei der eigentliche Wirkstoff GS-441524.
(II)
Die chemische Bindung zwischen Ribose und Base ist eine so genannte N-glykosidische Bindung zwischen einem Kohlenstoff- und einem Stickstoff-Atom (Hemi-Aminal-Bindung). Bei Remdesivir sind Zucker und Nukleobase jedoch über eine C-C-Bindung glykosidisch verknüpft.
Dies führt zu einer größeren Stabilität des Moleküls und erschwert den zellulären Enzym-Systemen (Nukleasen) den Abbau des Moleküls durch Abspaltung der Ribose; letztendlich gewährleistet diese Struktur den unbeschadeten Eintritt des Wirkstoffs an den Wirkort.
(III)
Aus chemischer Sicht auffälligstes und ungewöhnliches Merkmal des Remdesivir-Moleküls ist die Cyano-Gruppe -C≡N am 1'-C-Atom der Glykosid-Bindung. Während der Entwicklung des Wirkstoffs zeigten sich Vorgänger zwar als sehr potente Hemmstoffe der viralen RNA-Polymerasen – diese Substanzen blockierten allerdings auch effektiv die mitochondriale RNA-Polymerase der Wirtszellen, was unerwünscht ist und diese schädigt. Die Forscher mussten daher chemische Modifikationen am Molekül vornehmen, die diese toxische Nebenwirkung nicht auslösen. Dazu wurden mehrere verschiedene Substituenten am 1'-C-Atom ausprobiert und getestet; schlichtweg zeigte sich die Cyano-Gruppe am besten geeignet, um die Virus-Polymerase zu hemmen, ohne von der Wirtspolymerase verarbeitet zu werden.
(IV) und (V)
Die Hydroxy-Gruppe (IV) und die beiden Stickstoff-Atome am 6-Ring der Base (V) schließlich sind - wie beim Adenosin - die entscheidenden Strukturen bei der RNA-Synthese.
Die Basenseite (V) ist an der Basenpaarung mit Uracil bei der Biosynthese des RNA-Doppelstrangs beteiligt. Die Forschung geht derzeit davon aus, dass die bioaktivierte Wirkstoffkomponente in die wachsende virale RNA-Sequenz eingebaut wird.
Letzlich entscheidende Komponente ist die 3'-Hydroxygruppe am Zucker, die am Aufbau des Rückgrats der RNA beteiligt ist. Neuere Forschungsergebnisse legen nahe, dass zunächst mehrere Wirkstoff-Moleküle in den RNA-Strang eingebaut werden, bevor es zu einem Kettenabbruch kommt und die Vermehrung des Virus gehemmt wird; d. h., dass mehrere Additions-Zyklen durchlaufen werden, bis der Terminierungseffekt einsetzt. Die dadurch zusätzlich in die RNA eingebauten Nukleotide könnten auch bewirken, dass Remdesivir den Wirkstoff Korrekturlesenzymen schützt, die nicht-natürliche Nukleotidanaloga entfernen.
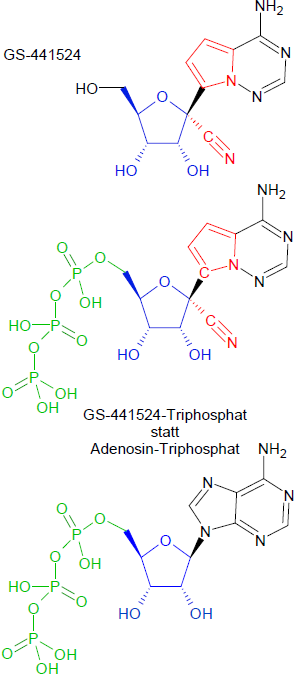
Die Formeln oben zeigen abschließend den eigentlichen Wirkstoff GS-441524 und - zum Vergleich - die dreifach phosphorylierten und damit bioaktivierten Moleküle Adenosintriphosphat und GS-441524-triphosphat.
Detail-Informationen zum Wirkstoff in englischer Sprache: Siehe unter DrugBank DB14761 (Wirkstoff-Datenbank).
Gefahren-Hinweise nach GHS
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit! Die Angaben ersetzen weder das Sicherheitsdatenblatt Chemikalien noch eine Gefährdungsbeurteilung, sondern geben eine allgemeine Übersicht hinsichtlich der Gefährdung durch den Gefahrstoff.)

Signalwort: Gefahr
Gefahrenhinweise (H-Sätze):
H372Schädigt die Organe bei längerer oder wiederholter Exposition.
H373
Kann die Organe schädigen bei längerer oder wiederholter Exposition.
Kennzeichnung in der EU: Siehe ECHA Substance Infocard 100.302.974.
Hinweis: Die Kennzeichnungspflicht gemäß CLP-Verordnung gilt unter anderem nicht für bestimmte Stoffe und Gemische für Endverbraucherinnen und Endverbraucher, die in Form von Fertigerzeugnissen vorliegen, wie zum Beispiel Arzneimittel, Tierarzneimittel, Kosmetika, bestimmte Medizinprodukte und medizinische Geräte, Lebensmittel oder Futtermittel sowie bestimmte Lebensmittelzusatzstoffe oder Aromastoffe. Hier sind gegebenenfalls gesonderte rechtliche Vorschriften einzuhalten.
Prodrug
Remdesivir ist ein so genanntes Prodrug, das heisst, dass die Substanz erst nach Einnahme im Organismus in seine pharmakologisch aktive Form GS-441524 metabolisiert und als Triphosphat bioaktiviert wird.
Externe Informationsquellen
Hersteller und Bezugsquellen
In der nachfolgenden Tabelle sind Produzenten und Lieferanten von Remdesivir als kommerzielle Chemikalie für Labor, Forschung, Industrie und Produktion mit den entsprechenden Kontaktdaten verzeichnet.
Literatur und Quellen
[0] - Fach- und Forschungsartikel in wissenschaftlichen Zeitschriften via PubMed: Remdesivir.
[1] - Warren, T., Jordan, R., Lo, M. et al.:
Therapeutic efficacy of the small molecule GS-5734 against Ebola virus in rhesus monkeys.
In: Nature 531, 381 - 385, (2016), DOI 10.1038/nature17180.
[2] - Niels C. Pedersen, Michel Perron, Michael Bannasch, Elizabeth Montgomery, Eisuke Murakami, Molly Liepnieks, Hongwei Liu:
Efficacy and safety of the nucleoside analog GS-441524 for treatment of cats with naturally occurring feline infectious peritonitis.
In: Journal of Feline Medicine and Surgery, (2019), DOI 10.1177/1098612X19825701.
[3] - Manli Wang, Ruiyuan Cao, Leike Zhang, Xinglou Yang, Jia Liu, Mingyue Xu, Zhengli Shi, Zhihong Hu, Wu Zhong und Gengfu Xiao:
Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro.
In: Cell Research, 30, 269 - 271, (2020), DOI 10.1038/s41422-020-0282-0.
[4] - Susan Amirian und Julie K. Levy:
Current knowledge about the antivirals remdesivir (GS-5734) and GS-441524 as therapeutic options for coronaviruses.
In: One Health, (2020), DOI 10.1016/j.onehlt.2020.100128.
[5] - Shreesha Bhat:
Mackman Synthesis of Remdesivir.
In: Organic Chemistry Portal, (2020), DOI https://www.organic-chemistry.org/totalsynthesis/totsyn07/remdesivir-mackman.shtm.
Letzte Änderung am 10.03.2024.
Permalink: https://www.internetchemie.info/substanz/Remdesivir.php
© 1996 - 2025 Internetchemie ChemLin