
Samarium - chemisches Zeichen Sm, Ordnungszahl 62 - ist ein silberglänzendes, ziemlich luftbeständiges, in zwei Modifikationen auftretendes, metallisches chemisches Element aus der Gruppe der Lanthanoide (Seltene Erden).
Die kommerzielle Hauptanwendung von Samarium liegt in Herstellung von Samarium-Cobalt-Magneten, deren Permanent-Magnetisierung nach Neodym-Magneten an zweiter Stelle steht. Samariumverbindungen können auf Grund des höheren Curie-Punkts der Legierung deutlich höheren Temperaturen von über 700 °C standhalten, ohne ihre magnetischen Eigenschaften zu verlieren.
Samariumsalze stimulieren den Stoffwechsel - es ist jedoch unklar, ob dies die Wirkung von Samarium oder anderen darin enthaltenen Lanthaniden ist. Die Gesamtmenge an Samarium bei Erwachsenen beträgt etwa 50 μg, hauptsächlich in Leber und Nieren, etwa 8 μg davon sind im Blut gelöst.
Samarium wird von Pflanzen nicht in messbaren Konzentrationen aufgenommen; daher ist das Seltenerdmetall normalerweise auch kein Bestandteil der menschlichen Ernährung. Unlösliche Salze von Samarium sind ungiftig und die löslichen sind nur geringfügig toxisch.
Übersicht: Allgemeine Daten zum Samarium
Das Samarium-Atom
Das Sm-Atom - und damit das chemische Element Samarium - besitzt 62 positiv geladene Protonen im Atomkern und - im ungeladenen Samarium-Atom - die gleiche Anzahl an Elektronen in der Atomhülle.
Für Unterschiede bei den Atomkernen sorgen die Kernbausteine der Neutronen. Diese Atomsorten werden unter dem Begriff Samarium-Isotope zusammengefasst (Isotopen-Daten: siehe dort).
Die irdischen Samarium-Vorkommen bestehen aus einem Isotopengemisch aus vier verschiedenen Nukliden. Die relative Atommasse des Samariums wird mit 150,36(2) u angegeben.
Elektronenkonfiguration
| Symbol | OZ | Kurzform | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 6s | 6p | 6d | 6f |
| Sm | 62 | [Xe] 4f6 6s2 | 2 | 2 | 6 | 2 | 6 | 10 | 2 | 6 | 10 | 2 | 6 | 2 |
Ionisierungsenergien
Die folgende Tabelle listet die Bindungsenergien bzw. die Ionisierungsenergien IE des Samariums auf, also die erforderliche Energie in Elektronenvolt (eV), um ein bestimmtes Elektron von einem Sm-Atom zu trennen.
| 1. IE: | 5,6437 eV | 2. IE: | 11,07 eV | 3. IE: | 23,4 eV | 4. IE: | 41,4 eV | 5. IE: | eV | 6. IE: | eV |
Elektronenbindungsenergie
Die nachfolgende Tabelle listet die Elektronenbindungsenergien der einzelnen Samarium-Elektronen in den jeweiligen Orbitalen auf. Die Werte sind in Elektronenvolt (eV) angegeben.
| K | LI | LII | LIII |
| 1s | 2s | 2p1/2 | 2p3/2 |
| 46834 | 7737 | 7312 | 6716 |
| MI | MII | MIII | MIV | MV |
| 3s | 3p1/2 | 3p3/2 | 3d3/2 | 3d5/2 |
| 1723 | 1541 | 1420 | 1110,9 | 1083,4 |
| NI | NII | NIII | NIV | NV | NVI | NVII |
| 4s | 4p1/2 | 4p3/2 | 4d3/2 | 4d5/2 | 4f5/2 | 4f7/2 |
| 347,2 | 265,6 | 247,4 | 129 | 129 | 5,2 | 5,2 |
| OI | OII | OIII | OIV | OV |
| 5s | 5p1/2 | 5p3/2 | 5d3/2 | 5d5/2 |
| 37,4 | 21,3 | 21,3 |
Weitere Daten
185 pm (empirisch, nach Slater)
172 pm (in Einfach-Bindungen, nach Pyykkö et al.)
134 pm (in Zweifach-Bindungen, nach Pyykkö et al.)
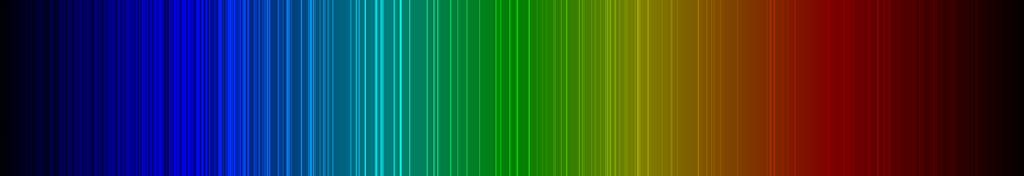
Spektrallinien des Samariums
Die nachfolgende Abbildung zeigt ein Emissionsspektrum des Samariums mit den charakteristischen Spektrallinien im sichtbaren Wellenlängenbereich zwischen 400 und 700 nm:
Chemie des Samariums
Frisch zubereitete Samarium-Oberflächen zeigen einen silbrigen Glanz. An der Luft bei Raumtemperatur oxidiert das Metall langsam; es entzündet sich spontan bei 150 °C.
Samarium ist ziemlich elektropositiv und reagiert langsam mit kaltem Wasser und schneller mit heißem Wasser unter Bildung von Samariumhydroxid.
Die beständigste Oxidationsstufe der Samarium-Verbindungen ist - wie bei allen Lanthanoiden - +III. Darüber hinaus ist eines der wenigen Lanthaniden, die die Oxidationsstufe +2 aufweisen können.
Chemische Daten
Standardpotentiale
Normalpotential des Samariums:
| E0 (V) | Nox | Name Ox. | Ox. | e- | ⇔ | Red. | Name Red. | Nox |
| -2,68 | + II | Samarium(II)-Kation | Sm2+ | + 2 e- | ⇔ | Sm (s) | Samarium | 0 |
| -2,304 | + III | Samarium(III)-Kation | Sm3+ | + 3 e- | ⇔ | Sm (s) | Samarium | 0 |
| -1,55 | + III | Samarium(III)-Kation | Sm3+ | + e- | ⇔ | Sm2+ | Samarium(II)-Kation | + II |
Material- und physikalische Eigenschaften des Samariums
Die nachfolgende Übersicht führt einige physikalische Daten sowie Materialeigenschaften des reinen, elementaren Samarium-Metalls auf.
0,197 J g-1 K-1 (spezifisch)
7,16 g cm-3 (flüssig, am Schmelzpunkt)
nach Brinell: 0,441 GPa
206,7 kJ mol-1 (gasförmig)
183,0 J mol-1 K-1 (gasförmig)
Unter normalen Umgebungsbedingungen nimmt das Samarium eine rhomboedrische Struktur an, die als α-Sm bezeichnet wird. Beim Erhitzen auf 731 °C ändert sich die Kristallsymmetrie in eine hexagonal dichte Packung (hcp), die Übergangstemperatur hängt jedoch von der Metallreinheit ab. Durch weiteres Erhitzen auf 922 ° C wird das Metall in eine kubisch-raumzentrierten Phase (bcc) umgewandelt.
Das Erhitzen auf 300 °C in Kombination mit einer Kompression auf 40 kbar führt zu einer doppelt hexagonal dicht gepackten Struktur (dhcp). Das Anlegen eines noch höheren Drucks in der Größenordnung von Hunderten oder Tausenden von Kilobar induziert eine Reihe von Phasenumwandlungen, insbesondere mit einer tetragonalen Phase, die bei etwa 900 kbar auftritt. Auch Dünnschichten, die durch Aufdampfen von Samarium erhalten werden, können als hcp oder dhcp- Phasen unter normalen Umgebungsbedingungen vorliegen.
Samarium ist bei Raumtemperatur paramagnetisch. Das entsprechende effektive magnetische Momente liegt unter 2μB und ist nach Lanthan und Lutetium das niedrigste unter den Lanthanoiden. Samarium wandelt sich beim Abkühlen auf 14,8 K in einen antiferromagnetischen Zustand um.
Geochemie, Vorkommen, Verteilung
Mit einer durchschnittlichen Konzentration von etwa 8 ppm steht Samarium an 40. Stelle der Häufigkeiten der chemischen Elemente in der Erdkruste. Es ist das fünfthäufigste Lanthanoid und häufiger als Zinn. Die Samariumkonzentration in Böden variiert zwischen 2 und 23 ppm; die Ozeane enthalten etwa 0,5 bis 0,8 Teile pro Billion.
Samarium kommt nicht als freies Metall in der Natur vor, ist aber - wie andere Seltenerdelemente - in vielen Mineralien als Begleiter enthalten, darunter Monazit, Bastnäsit, Cerit , Gadolinit und Samarskit. Monazit (Samarium-Konzentration von bis zu 2,8%) und Bastnäsit werden meist als kommerzielle Quellen verwendet. Mit Abstand größter Produzent ist derzeit China; daneben gibt es Vorkommen in den USA, Brasilien, Indien, Sri Lanka und Australien.
Gefahren und Sicherheit
(Allgemeine Hinweise ohne Gewähr auf Richtigkeit und Vollständigkeit)

Achtung
H228 - Entzündbarer Feststoff.
H261 - In Berührung mit Wasser entstehen entzündbare Gase.
Quelle: Echa Substanz-Info 100.028.298.
Literatur und Quellen
[1] - Stanislav Strekopytov:
Salute to samarium.
In: Nature Chemistry, 2016, DOI 10.1038/nchem.2565, open access.
Externe Informationsangebote
Gruppenelemente - Informationen
Lanthanoid Trennung
Gewinnung und Trennung von Lanthanoiden. FH Münster - Format: PDF
Lanthanoide
Entdeckung der Lanthanoide; Besonderheiten der Lanthanoide; Elektronenkonfigurationen; Ionenaustauscherverfahren; Lanthanoidenkontraktion; Oxidationsstufen; Verwendung. Universität Bayreuth
Lanthanoide
Allgemeines, Trennung, Gewinnung, Eigenschaften, 4f-Orbitale etc.. Universität Bielefeld
Lanthanoide
Vorlesungsmaterialien: Chemie der Metalle. Universität Freiburg
Seltenerdmetalle
Vergleichende Übersicht der Seltenen Erde mit tabellarisch aufgeführten physikalischen und chemischen Eigenschaften des Neodyms
Einzelne Verbindungen
Samarium und Samariumverbindungen
Chemikalien-Datenbank: physikalische und chemische Eigenschaften, Sicherheitsdatenblätter, kommerziell verfügbaren Stoffen und Verbindungen; verschiedene Suchkriterien einschließlich Struktursuche
Samariumverbindungen
Liste der Samariumverbindungen mit Formeln, Eigenschaften, Datenquellen usw
Geochemie und Biogeochemie
Seltenerdmineralien
Auflistung und prozentuale Zusammensetzung der einzelnen in der Natur auftretenden, Seltene Erden enthaltenen Mineralien
Dissertationen
Hochauflösende Resonanzionisationsspektroskopie
... an Samarium und Gadolinium. Dissertation, 2002. Universität Mainz
Recycling Seltener Erden
... aus Permanentmagneten und Leuchtstoffabfällen mittels Feststoffchlorierung. Dissertation, (2018). TU Freiberg
Samarium(III) aktivierte Wolframatverbindungen
Untersuchung der Lumineszenzeigenschaften Eu3+ und Sm3+ aktivierter Wolframatverbindungen. Dissertation, 2009. Universität Osnabrück
Samariumcarbid
Synthese, strukturelle und physikalische Charakterisierung von Seltenerdcarbiden. Dissertation, 2007. Universität Köln
Kategorie: Chemische Elemente
Aktualisiert am 16.04.2020.
Permalink: https://www.internetchemie.info/chemische-elemente/samarium.php
© 1996 - 2026 Internetchemie ChemLin