
Titan - Symbol Ti, Ordnungszahl 22 - ist in reiner Form ein in hexagonal dichtester Kugelpackung kristallisierendes, silberweißes, duktiles, leicht schmiedbares, metallisches chemisches Element. Ti ist erstes Glied der Titangruppe und zählt zu den Übergangselementen und den Leichtmetallen.
Die zwei nützlichsten Materialeigenschaften des Metalls sind die Korrosionsbeständigkeit und das Verhältnis von Festigkeit zu Dichte, die höchste aller metallischen Elemente. Titan ist im unlegierten Zustand so stark wie manche Stähle, aber weniger dicht und damit leichter.
Übersicht: Allgemeine Daten zum Titan
Das Titan-Atom
Das Ti-Atom - und damit das chemische Element Titan - ist eindeutig durch die 22 positiv geladenen Protonen im Atomkern definiert. Für den elektrischen Ausgleich im ungeladenen Titan-Atom sorgt die gleiche Anzahl an Elektronen.
Für Unterschiede bei den Atomkernen sorgen die Kernbausteine der Neutronen. Diese Atomsorten werden unter dem Begriff Titan-Isotope zusammengefasst (Isotopen-Daten: siehe dort).
Die irdischen Titan-Vorkommen bestehen mehreren verschiedenen Titan-Nukliden; die relative Atommasse des Titans wird mit 47,867(1) u angegeben.
Elektronenkonfiguration
| Symbol | OZ | Kurzform | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f |
| Ti | 22 | [Ar] 3d2 4s2 | 2 | 2 | 6 | 2 | 6 | 2 | 2 |
Ionisierungsenergien
Die folgende Tabelle listet die Bindungsenergien bzw. die Ionisierungsenergien IE des Titans auf, also die benötigte Energie in Elektronenvolt (eV), um ein bestimmtes Elektron von einem Ti-Atom zu trennen.
| 1. IE: | 6,82812 eV | 2. IE: | 13,5755 eV | 3. IE: | 27,4919 eV | 4. IE: | 43,2675 eV | 5. IE: | 99,30 eV | 6. IE: | 119,53 eV |
| 7. IE: | 140,8 eV | 8. IE: | 170,4 eV | 9. IE: | 192,1 eV | 10. IE: | 215,92 eV | 11. IE: | 265,07 eV | 12. IE: | 291,502 eV |
| 13. IE: | 787,84 eV | 14. IE: | 863,1 eV | 15. IE: | 941,9 eV | 16. IE: | 1044 eV | 17. IE: | 1131 eV | 18. IE: | 1221 eV |
| 19. IE: | 1346 eV | 20. IE: | 1425,4 eV | 21. IE: | 6249,0 eV | 22. IE: | 6625,87 eV | 23. IE: | eV | 24. IE: | eV |
Elektronenbindungsenergie
Die nachfolgende Tabelle listet die Elektronenbindungsenergien der einzelnen Titan-Elektronen in den jeweiligen Orbitalen auf. Die Werte sind in Elektronenvolt (eV) angegeben.
| K | LI | LII | LIII |
| 1s | 2s | 2p1/2 | 2p3/2 |
| 4966 | 560,9 | 460,2 | 453,8 |
| MI | MII | MIII | MIV | MV |
| 3s | 3p1/2 | 3p3/2 | 3d3/2 | 3d5/2 |
| 58,7 | 32,6 | 32,6 |
Weitere Daten
140 pm (empirisch, nach Slater)
136 pm (in Einfach-Bindungen, nach Pyykkö et al.)
117 pm (in Zweifach-Bindungen, nach Pyykkö et al.)
108 pm (in Dreifach-Bindungen, nach Pyykkö et al.)
Ionenradius
Ionenradien der Ti(II)-, Ti(III)- und Ti(IV)-Kationen in pm:
| Ion | KoZ | Ieffektiv | Ikristall | Anmerkungen |
|---|---|---|---|---|
| Ti2+ Ti3+ Ti4+ Ti4+ Ti4+ | 6 6 4 6 8 | 86 67 42 60,5 74 | 100 81 74,5 |
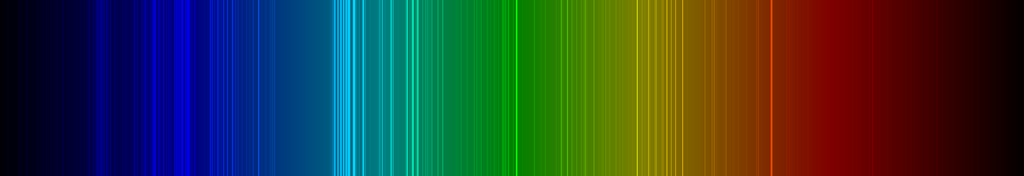
Spektrallinien des Titans
Die nachfolgende Darstellung zeigt ein Emissionsspektrum des Titans mit den charakteristischen Spektrallinien im sichtbaren Wellenlängenbereich zwischen 400 und 700 nm:
Chemie des Titans
Titan und seine Legierungen oxidieren rasch durch die Einwirkung von Feuchtigkeit und den Sauerstoff der Luft. Bei normalen Umgebungstemperaturen bildet sich eine schützende Oxidschicht (Passivierung) zunächst von 1 bis 2 nm Dicke, die langsam bis auf 25 nm anwächst, das Metall effektiv vor weiterer Oxidation schützt und dem Titan eine ausgezeichnete Korrosionsbeständigkeit verleiht, die dem des Platins vergleichbar ist. Passivierte Titan-Metall ist dabei beständig selbst gegen die Einwirkung von verdünnter Salzsäure und Schwefelsäure, Chlorid-Lösungen (Salz), vieler organischer Säuren u. a.
Nicht-passiviertes Titan ist ein sehr reaktives Metall, das in Luftsauerstoff schon unterhalb des Schmelzpunktes unter Bildung von Titandioxid verbrennt. Das Schmelzen ist daher nur in einer inerten Atmosphäre oder im Vakuum möglich. Und es ist eines der wenigen Elemente, die in reinem Stickstoff verbrennen; so setzt sich Titan bei 800°C zu Titannitrid um.
Dominierend in der Titanchemie ist die Oxidationsstufe +IV; daneben sind Ti(III)-Verbindungen stabil und gelegentlich anzutreffen.
Die Koordinationsgeometrie der vierwertigen Titanverbindungen ist in der Regel oktaedrisch; eine Ausnahme ist beispielsweise das tetraedrische Titan(IV)-chlorid.
Chemische Daten
1,38 nach Allen
3,0040 eV nach Gosh-Gupta
3,45 eV nach Pearson
Standardpotentiale
Normalpotential des Titans:
| E0 (V) | Nox | Name Ox. | Ox. | e- | ⇔ | Red. | Name Red. | Nox |
| -1,63 | + II | Titan(II)-Kation | Ti2+ | + 2 e- | ⇔ | Ti (s) | Titan | 0 |
| -1,37 | + III | Titan(III)-Kation | Ti3+ | + 3 e- | ⇔ | Ti (s) | Titan | 0 |
| -1,31 | + II | Titanmonoxid | TiO (s) + 2 H+ | + 2 e- | ⇔ | Ti (s) + H2O | Titan | 0 |
| -1,23 | + III | Titan(III)-oxid | Ti2O3 + 2 H+ | + 2 e- | ⇔ | 2 TiO (s) + H2O | Titanmonoxid | + II |
| -0,56 | + IV | Titandioxid | 2 TiO2 (s) + 2 H+ | + 2 e- | ⇔ | Titan(III)-oxid | + III |
Material- und physikalische Eigenschaften des Titans
Die nachfolgende Übersicht führt einige physikalische Daten sowie Materialeigenschaften des reinen Titan-Metalls auf.
0,523 J g-1 K-1 (spezifisch)
4,11 g cm-3 (flüssig, am Schmelzpunkt)
nach Vickers: 0,97 GPa
nach Brinell: 0,716 GPa
nach Brinell (neu): 1,028 GPa (geglüht)
473,0 kJ mol-1 (gasförmig)
180,3 J mol-1 K-1 (gasförmig)
Neben der α-Modifikation tritt Titan bei 882 °C in die β-Form über, die eine kubisch-raumzentrierte Kristallstruktur aufweist.
Geochemie, Vorkommen, Verteilung
Titan ist das siebthäufigste Metall in der Erdkruste. Es ist in den meisten magmatischen Gesteinen, in den davon abgeleiteten Sedimenten, in Lebewesen und in natürlichen Gewässern in Form seines Oxids vorhanden.
Externe Informationsangebote
Gruppenelemente - Informationen
Titangruppe
Vorlesungsmaterialien: Chemie der Metalle - IV. Nebengruppe / 4. Gruppe. Universität Freiburg
Übergangsmetalle
Vorlesungsskript: Chemie der Übergangselemente, Koordinationschemie, Stoffchemie - Format: PDF
Übergangsmetalle
Übergangsmetalle Gruppen 3-12; Innere Übergangsmetalle. Universität Marburg - Format: PDF
Einzelne Verbindungen
Oxo-Verbindungen der Titangruppe
Strukturen in Abbildungen. Universität Mainz - Format: PDF
Titan und Titanverbindungen
Chemikalien-Datenbank: physikalische und chemische Eigenschaften, Sicherheitsdatenblätter, kommerziell verfügbaren Stoffen und Verbindungen; verschiedene Suchkriterien einschließlich Struktursuche
Titandioxid
Eigenschaften, Rohstoffe und Lagerstätten, Erzaufbereitung, Sulfatverfahren, Chloridverfahren, Ökologie. Thomas Seilnacht
Chemische Reaktionen
Übergangsmetall-katalysierte Reaktionen
Vorlesungsskript. Universität des Saarlandes - Format: PDF
Synthese, Herstellung, Produktion
Titan - Herstellung und Anwendung
Vorkommen, Herstellung, Anwendung von Titanwerkstoffen. Universität Bayreuth
Übergangsmetalle
Gewinnung und Reinigung. FH Münster - Format: PDF
Übergangsmetalle
Skript: Gewinnung und Reinigung der Übergangsmetalle - Format: PDF
Metallorganische Chemie und Reagenzien
Koordinations- und Übergangsmetallchemie
Vorlesungsmaterialien zur Anorganischen Chemie. FH Münster - Format: PDF
Mineralogie
Titanhaltige Minerale
Informationen zum Titan und den Titanmineralien. Mineralien Atlas
Dissertationen
Titankomplexe
Neue Titan- und Zirconiumkomplexe für die homogene Olefinpolymerisation. Dissertation, 2000. Universität Bochum
Titankomplexe mit Pentalenliganden
Synthese und Reaktionen von Titankomplexen mit Pentalenliganden. Dissertation, 2000. Universität Bochum
Organisationen, Verbände
International Titanium Association
ITA, USA - [e]
Kategorie: Chemische Elemente
Aktualisiert am 15.05.2020.
Permalink: https://www.internetchemie.info/chemische-elemente/titan.php
© 1996 - 2026 Internetchemie ChemLin